|
|
Prywatny
Gabinet Kardiologiczny
dr
n. med. specjalista kardiologii i chorób wewnętrznych
Katarzyna Ciuraszkiewicz
Lekarz Kardiolog Kielce
25-017
Kielce, ul. Paderewskiego 4a/12,
tel. 532-263-133
e-mail: kardiologiastrona@gmail.com
|
Marianna Janion, Janusz Sielski, Katarzyna Ciuraszkiewicz
Oddział Kardiologii Wojewódzkiego Szpitala Zespolonego w Kielcach
Ustawiczny częstoskurcz komorowy u chorego po zawale serca,
opanowany farmakoterapią
Wstęp
Częstoskurcz
komorowy to rytm pochodzenia komorowego o częstości co
najmniej 100/min [1]. Wyróżniamy dwie postacie częstoskurczu
komorowego: monomorficzną - gdy kształt zespołów QRS jest
niezmienny, i polimorficzną - ze zmiennym kształtem lub osią
zespołów QRS [2]. Inny podział uwzględnia różny czas
trwania atytmii. Wyróżniamy zatem częstoskurcz nieutrwalony
składający się minimum z 3 zespołów QRS, częstoskurcz utrwalony o
czasie trwania co najmniej 30 s (czasem za granicę przyjmuje się15 s)
oraz częstoskurcz ustawiczny - przebiegający przewlekle naprzeminnie z
rytmem zatokowym, trwający przez dni i lata [1, 3, 4].
U ponad połowy pacjentów leczonych z
powodu nawracającego częstoskurczu komorowego przyczyną wyjściową jest
choroba niedokrwienia serca. Inne przyczyny wystąpienia częstoskurczu
to: kardiomiopatia zastoinowa i przerostowa, wypadanie płatka zastawki
mitralnej, wady zastawkowe, wady wrodzone serca [5].
Istnieje kilka patomechanizmów
powstawania częstoskurczu komorowego. U chorych po zawale serca
najważniejszą rolę odgrywa zjawisko reentry. Anatomicznie w bliźnie
pozawałowej wykazano obecność żywych komórek mięśnia sercowego,
które przewodzą impulsy z opóźnieniem i stanowią wolną
część pętli reentry [6-8]. Nieprawidłowe przewodzenie impulsów
na granicy blizny zawałowej i prawidłowej tkanki mięśniowej jest
arytmogenne [8, 9]. Chorzy w przebiegu ostrego zawału serca narażeni są
również na wystąpienie częstoskurczu komorowego w mechaniźmie
zwiększonego automatyzmu ośrodków ektopicznych oraz powstawania
póżnych potencjałów następczych [10].
Niedotleninie, zasadowica i rozciągnięcie
włókien przewodzących prowadzą do wzrostu automatyzmu
fizjologicznego włókien Purkinjego przez wzrost nachylenia 4
fazy potencjału czynnościowego, a także przez przesunięcie w kierunku
zera maksymalnego potencjału rozkurczowego. Uważa się, że u podstawy
tego zjawiska leży prąd rozkurczowy, płynący z częściowo
zdepolaryzowanych w skutek nidokrwienia roboczych włókien
mięśnia komór, w kierunku sąsiadujących, bardziej opornych na
niedokrwienie włókien Purkinjego, przyspieszając ich
spontaniczną depolaryzację [2].
Opóźnione potencjały następcze występują wtedy,
gdy zwiększa się wewnątrzkomórkowe stężenie wapnia: w ostrym
zawale serca, ztruciu naparstnicą, katecholaminemii. Gdy amplituda
depolaryzacji następczych osiągnie poziom potencjału progowego, stają
się one źródłem pobudzeń przedwczesnych, pojedynczych lub
złożonych. Typowym przykładem tej arytmii jest monomorficzny częstoskurcz komorowy [2].
U podstaw wystąpienia częstoskurczu komorowego może
być także zjawisko parasystolii, czyli obecnościniezależnego, czynnego
ośrodka może być także zjawisko parasystolii, czyli obecności
niezależnego, czynnego ośrodka ektopicznego, którego czynność
bodźcotwórcza chroniona jest przed rozładowaniem impulsem rytmu
podstawowego, blokiem ochronnym (blokiem jednokierunkowym). Częstoskurcz
parasystoliczny jest wolniejszy niż inne postacie częstoskurczu i
zazwyczaj ma częstotliwość 70-150/min [10].
Do najczęściej spotykanych objawów towarzyszących
wystąpieniu częstoskurczu komorowego zaliczamy: kołatanie serca, uczucie
pulsowania w szyi, duszność, zawroty głowy, utraty przytomności. Rzadko
przebieg częstoskurczu może być klinicznie bezobjawowy - najczęściej
występuje u chorych w pozycji leżącej, przy dobrej wyjściowo
hemodynamicznej czynności serca oraz w przypadku jego niewielkiej
częstości [9].
Rozpoznanie częstoskurczu komorowego opiera się
głównie na analizie zapisu EKG. Podstawowe kryteria
elektrokardiograficzne rozpoznania to: poszerzenie zespołu QRS powyżej
0,14 s, obecność rozkojarzenia przedsionkowo-komorowego, morfologia QRS
[1].
Za komorowym pochodzeniem arytmii przemawiają:
- zespoły QRS o cechach bloku prawej odnogi w odprowadzeniu V1
jednofazowe z szerokim i wysokim załamkiem R, dwufazowe typu qR, lub
RS, bądź Rsr;
- zespoły QRS o cechach bloku lewej odnogi z poszerzonym i niskim załamkiem R w V1;
- zgodny i dodatni kierunek zespołów QRS w odprowadzeniach V1-V6;
- zespoły QS w II, II, a VF lub V5-V6 [2].
W niniejszym artykule przedstawiamy przypadek trwającego
wiele dni ustawicznego częstoskurczu komorowego z objawami zespołu
małego rzutu, skutecznie leczonego farmakologicznie.
Opis przypadku
Chorego w wieku 45 lat, od 3 dni leczonego nieskutecznie
na oddziale wewnętrznym, przeniesiono na oddział kardiologii w stanie
ciężkim z objawami zespołu małego rzutu i współistnijącym
naprzemiennie z pojedyńczymi ewolucjami rytmu zatokowego ustawicznym częstoskurczem komorowym.
W wywiadzie stwierdzono, że przebył 5 lat wcześniej
zawał serca ściany przedniej i do czasu obecnej hospitalizacji nie
zgłaszał dolegliwości. Przyjęto go do szpitala z powodu nagłego uczucia
kołatania serca, osłabienia i okresowych dolegliwości bólowych w
klatce piersiowej. W badaniu przedmiotowym i podmiotowym stwierdzono:
utrudniony kontakt z pacjentem, nieoznaczalne ciśnienie tętnicze, bladą
i spoconą skórę. Nad polami płócnymi występowały
nieliczne trzeszczenia. Czynność serca ok. 170-180/min, okresowo
niemiarowa, tony ciche, szmer holosystolicznynad koniuszkiem. Tętno na
tętnicach obwodowych niewyczuwalne. Wątroba powiększona w małym
stopniu. W badaniach biochemicznych z odchyleń od normy stwierdzono:
hipercholesterolemię - LDL równy 180 mg/dL oraz podwyższone
wartości glikemii (kolejne oznaczenia = 140, 105, 90 mg/dl).
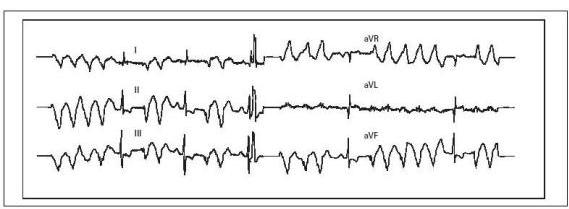
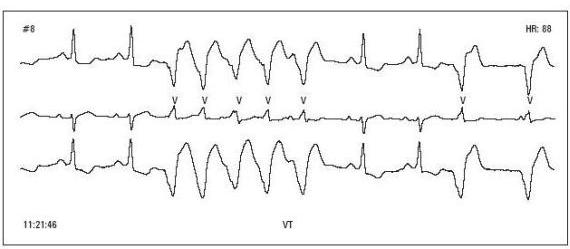
Ryc. 2
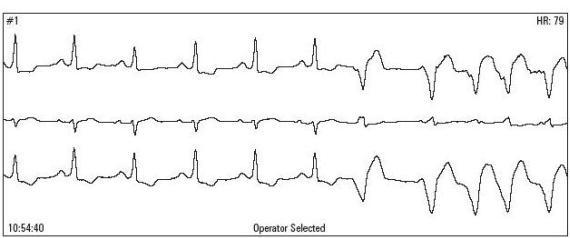
Ryc. 3
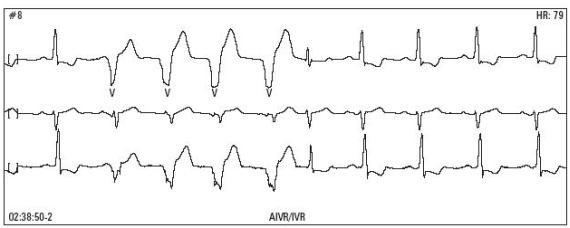
Ryc. 4
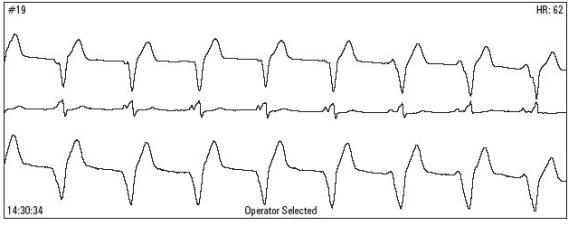
Ryc.5
Pacjenta przeniesiono na salę ogólną i poddano
rehabilitacji. W dwóch kolejnych zapisach EKG metodą Holtera,
wykonanych w 25 i 32 dobie pobytu, stwierdzono wiodący rytm zatokowy o
średniej częstości 65-70/min, redukcję przedwczesnych pobudzeń
komorowych z 29865 do 11322, par z 2132 do 740 oraz wstawek
częstoskurczu komorowego z 699 do 90. W wykonanej próbie
wysiłkowej na ergometrze rowerowym chory przy obciążeniu 75W uzyskał
czynność serca 127/min (co stanowi 70% limitu tętna wyznaczonego wg
wieku), bez dolegliwości bólowych w klatce piresiowej. W
zapisach EKG w czasie i po wysiłku nie obserwowano zaburzeń rytmu oraz
dynamicznych zmian odcinka ST. Nie zarejestrowano obecności
późnych potencjałów komorowych (ryc. 6). W kontrolnym
badaniu echokardiograficznym nadal stwierdzono powiększone jamy lewej
strony serca (LP - 54 mm, LK - 72/59 mm) i utrzymywanie się uprzednio
opisywanych, odcinkowych zaburzeń kurczliwości z poprawą frakcji
wyrzutowej do 46% (akineza ściany przedniej, przegrody międzykomorowej
z poszerzonym akinetyczno-dyskinetycznym koniuszkiem).
Pacjenta wypisano do domu z zaleceniem kontynuacji
terapii amiodaronem 400 mg/d., prokainamidem 1000 mg/d., kaptoprylem
37,5 mg/d., furosemidem, sorbonitem, potasem, magnezem oraz okresowej
kontroli poziomu amiodaronu i jego aktywnego metabolitu, okresowej
oceny odstępu QT, oznaczenia poziomu hormonów tarczycy.

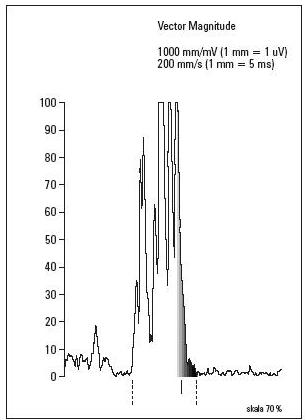
Ryc. 6
W kontrolnym badaniu echokardiograficznym wykonanym
w tym samym dniu stwierdzono zmniejszenie się wymiarów lewego
przedionka i lewej komory z poprawą jej kurczliwości w zakresie ściany
przedniej, przegrody międzykomorowej i koniuszka (akineza koniuszka,
hipokineza ściany przedniej i przegrody międzykomorowej) z frakcją
wyrzutową 48%.
Terapię amiodaronem i prokainamidem kontynuowano przez 18
miesięcy. Po tym okresie podjęto decyzję o odstawieniu prokainamidu. W
kontrolnym badaniu metodą Holtera wykonanym 2 tygodnie po zmianie
leczenia stwierdzono jedynie nieliczne pobudzenia przedwczesne komorowe
jednokształtne oraz obniżenie odcinka odcinka ST w różnie
długich odcinkach zapisu.
Aktualnie po 2-letniej obserwacji chory czuje się dobrze,
nie zgłasza dolegliwości bólowych w klatce piersiowej, przyjmuje
amiodaron 200mg/d., dwuazotan izosorbidu, kaptopryl 37,5 mg/d.,
okresowo furosemid i kwas acetylosalicylowy.
Omówienie
Postepowanie z chorym, u którego rozpoznajemy
częstoskurcz komorowy, jest uzależnione od obiawów choroby oraz
od stanu klinicznego. Jeżeli częstoskurcz przebiega z wyraźnymi
zaburzeniami hemodynamicznymi - postepowaniem z wyboru jest
kardiowersja elektryczna. Jeżeli stan chorego jest w miarę
zadowalający, a stan hemodynamiczny układu krążenia stabilny - leczenie
można rozpocząć od farmakoterapii. Jako leki pierwszego rzutu stosujemy
lidokainę, amiodaron, prokainamid i meksyletynę. W wypadku
nieskuteczności tych leków wskazane jest zastosowanie bretylium
lub propranololu. [11].
W przedstawionym przez nas przypadku, u pacjenta po
przebytym 5 lat wcześniej zawale serca stwierdzono ustawiczny,
wielodniowy częstoskurcz komorowy powikłany istotnymi zaburzeniami
hemodynamicznymi, spowodowanymi ipogłębionymi przez trwające
zaburzenia rytmu. Nie wykonano kardiowersji elektrycznej, ponieważ
pojedyncze ewolucje rytmu zatokowego często samoistnie nawracały.
Podjeto decyzję leczenia farmakologicznego, które miało
doprowadzićdo kompensacji układu krążenia oraz skojarzonego leczenia
antyarytmicznego (poczatkowo amiodaron i meksyletyna, a następnie
amiodaron i prokainamid).
W przypadkach opornych na farmakoterapię,
szczególnie w ustawicznym częstoskurczu komorowym, można
stosować inne metody lecznicze: zabiegi operacyjne, ablacje
przezskórne, fotoablacje, przeszczep serca itp.[11-13].
Leczenie chirurgiczne polega na wycięciu pod kontrolą
operatora okolicy tętniaka. Metodą znacznie skuteczniejszą jest
aneuryzmektomia poszerzona, sięgająca do granic obszarów
zdrowego mięśnia sercowego. Znacznie bezpieczniejsze, ale wymagające
dokładniejszego oznaczenia miejsc częstoskurczu są metody: Harkena
resekcji endokardialnej, kardioablacji zastosowana przez Coxa i metoda
fotoablacji zastosowana przez Selle [12, 14]. Chorzy z napadowym
częstoskurczem komorowymstanowią grupę zagrożoną nagłym zgonem
sercowym, która wymaga przeprowadzenia kompleksowej diagnostyki
specjalistycznej - w tym badań inwazyjnych, aby ocenić ryzyko
powtórnego wystąpienia arytmii i wyboru odpowiedniej metody
leczenia [15]. Analizy ryzyka nawrotu częstoskurczu można dokonać na
podstawie wyników badań nieinwazyjnych, takich jak: badanie
echokardiograficzne stwierdzające frakcję wyrzutową mniejszą niż 40%,
obecność późnych potencjałów komorowych, ocena dyspersji
QT w badaniu Holtera [15-17].
Opisany przypadek jest przykładem ustawicznego
częstoskurczu monomorficznego, przebiegającego z istotnymi zaburzeniami
hemodynamicznymi skutecznie opanowanego skojarzonym leczeniem
amiodaronem i prokainamidem. Stabilizacja rytmu zatokowego
nastąpiła dopiero po 14 dniach intensywnej farmakoterapii. Według
naszej oceny na opanowanie stwierdzonych zaburzeń rytmu istotny wpływ,
poza stabilizacją hemodynamiczną (uzyskaną dzięki intensywnemu leczeniu
kompensującemu układ krążenia i zwolnieniu częstości częstoskurczu
komorowego z 180/min do 130/min) i nasycenio aminodaronem. miało
włączenie do leczenia prokainamidu. Wystąpienie arytmii spowodowane
było najprawdopodobniej obecnością blizny pozawałowej, która
stanowiła substrat arytmogenny.
Obecność blizny pozawałowej u pacjenta nadal stwarza
ryzyko nawrotu arytmii. Jednakże uwzględniając wyniki testów
nieinwazyjnych (brak progresji arytmii w próbie wysiłkowej, w
badaniu holterowskim bez nasilenia złośliwej arytmii komorowej, brak
późnych potencjałów, zmniejszenie wymiarów i
poprawa kurczliwości lewej komory w okresie 2-letniej obserwacji)
należy ocenić, czy zastosowane leczenie farmakologiczne było
skuteczne.

|
|